直腸癌是消化道常見惡性腫瘤之一,我國結直腸癌發病率和死亡率呈逐年上升趨勢。區域性進展期直腸癌(LARC)腫瘤體積大,易於侵犯其他臟器,淋巴引流較複雜,直接進行手術治療效果較差,系統治療顯得尤為重要。臨床試驗表明,新輔助治療可使直腸癌區域性癌腫縮小,降低區域性複發率,提高保肛可能性,已成為外科治療必不可少的技能,因此我們特邀陝西省人民醫院普外科邱健教授對LARC新輔助治療策略進行全面系統的解讀。
一、直腸癌的新輔助放化療
新輔助放化療(nCRT)是預防進展期直腸癌(LARC)術後區域性復發的重要治療手段,術前放療可使TME手術後10年區域性複發率降低50%,從11%降至5%[1];術前放化療優於術後放療,10年區域性複發率分別為7%與10%[2]。NCCN指南建議T3、T4或淋巴結陽性的區域性進展期直腸癌患者選擇新輔助放化療。
新輔助放化療可降期降級,有效降低了LARC的術後區域性復發,部分達到臨床完全緩解(cCR)的患者可採取觀察等待策略(Watch and Wait, W&W),患者持續cCR可避免外科手術,如果有腫瘤復發,可施行挽救性手術[3]。
但是,隨著新輔助放化療的推廣應用,其治療模式的不足也逐漸凸顯出來。第一種不足是放療帶來的放射性損傷。放療可增加患者發生吻合口漏(19.8%)、吻合口狹窄、腸道放射性腸炎、腸梗阻的機會。第二種不足是放療改變了手術治療流程,需要同期行預防性造口,再次手術還納造口。第三種不足是nCRT並未改善進展期直腸癌患者的長期生存。因此,針對LARC,“減毒”“增效”的新輔助治療成為業界探索的方向。
二、“減毒”的新輔助治療
2.1 篩選新輔助放化療獲益人群
2017年,歐洲腫瘤學會直腸癌臨床實踐指南應用高分辨核磁給予cT3精準分層,推薦cT3a/T3b區域性復發風險較小(5%)的一類患者直接給予高質量TME手術,避免術前放療。而對於T3c/T3d的直腸癌,N1-N2或存在壁外血管侵犯(EMVI+)需要接受新輔助放化療[4]。
2.2 直腸癌的新輔助化療(NAC)
2023年ASCO釋出來自北美的PROSPECT研究[5],納入T2N+、T3N0和T3N+的LARC患者1128例,研究NAC(選擇性放療)能否在這些患者取代nCRT。NAC(選擇性放療)給予6週期mFOLFOX6,評估腫瘤縮小20%以上者直接行TME手術,術後給予6週期mFOLFOX6輔助治療;退縮小於20%或未能完成術前化療者給予術前同步放化療。
中位隨訪58個月顯示:NAC組中,9.1%患者接受了術前放化療,1.4%患者接受術後放化療,89.5%的患者可豁免放療。NAC組的PFS非劣效於nCRT組(0.92,p=0.005,見圖1),NAC組pCR率21.9%,nCRT組pCR率為24.3%。5年PFS、OS均無明顯差異。NAC聯合選擇性放療策略已納入NCCN指南,作為T2N+、T3N0和T3N+ LARC的新輔助治療方式之一。PROSPECT研究顯示NAC與nCRT後5年區域性複發率均極低,分別為1.8%與1.6%,結合ESMO指南,對於復發風險較低的T3a/T3b患者可免於術前治療,而復發風險高的T3c/T3d/N+患者可採用NAC(選擇性放療)策略。
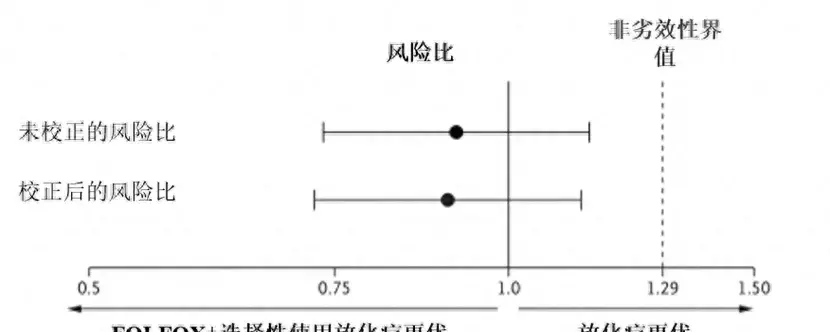
圖1. PROSPECT研究DFS的非劣性檢驗
2.3 新輔助免疫治療
錯配修復蛋白缺失(dMMR)/微衛星高度不不亂(MSI-H)是泛腫瘤PD-1單抗免疫治療有效性的預測標誌物。2022年, Cercek[6]報道dMMR/MSI-H的直腸癌12例,使用PD-1單抗Dostarlimab,每3週一次,連續使用6月,經MR、PET-CT、內鏡活檢、肛門指診證實直腸腫瘤完全消失,隨訪6~25月無復發徵象。儘管隨訪時間有限,但是該研究為直腸癌新輔助治療、免除手術、留存肛門及其功能提供了新的思路與方法。dMMR/MSI-H的 LARC新輔助免疫治療療效顯著,但是觀察時間仍然較短,對免疫治療使用時長、腫瘤區域性控制時間、是否能最終徹底免除手術等問題仍然需要觀察。
三、“增效”的新輔助治療
對於區域性高危復發風險的直腸癌,“增效”在於增加聯合治療強度,增強對放療的協同作用,增加新輔助放化療後病理完全緩解率(pCR)、減少區域性復發、留存器官、儘可能延長生存時間。比如我國的FOWARC研究[7]和CinClare研究[8],在單藥新輔助放化療基礎上,聯用奧沙利鉑或伊立替康後pCR分別達到27.5%和30%,但是仍未顯示增強化療後的生存獲益。
3.1全程新輔助放化療(TNT)
術後輔助化療因為患者耐受性下降,完成度不高可能影響生存獲益。將術後輔助化療全部提至手術前,序貫完成放療與全身化療,稱為全程新輔助放化療(TNT)。
RAPIDO研究[9]選擇區域性晚期直腸癌患者(T4/N2/EMVI+/MRF+/側方淋巴結+),研究組接受短程放療序貫CAPOX(FOLFOX4)再銜接手術,對照組為nCRT標準治療。兩組pCR率分別為28% vs 14%(OR 2.37,pp=0.019);3年遠處轉移率 20.0% vs 26.8%(HR 0.69, p=0.0048),提示TNT優於nCRT。而3年區域性復發 8.3% vs 6.0%(HR 1.42, p=0.12),提示原局控率已很高,在此基礎上難以獲得提升。3年OS 分別為89.1% vs 88.8%,(HR 0.92,p=0.5),並未顯示TNT帶來的生存優勢,可能需要延長觀察期限。
PEODIGE23研究[10]針對T3/T4 LARC,使用6週期FOLFIRINOX誘導化療後序貫CRT+手術+3月FOLFOX(CAPOX)輔助化療,對比CRT標準治療。兩組pCR率分別為28%與12%,3年區域性複發率分別為4%與6%(HR 0.78, p=0.56),3年DFS分別為76%與69% ( HR 0.69, p=0.034),3年無轉移生存率79% vs 72% (HR 0.64, p=0.017),3年OS顯示出了延長趨勢,為91% vs 88% (HR 0.65, p=0.0773), 提示強化新輔助化療可能透過減少全身轉移改善患者長期生存。
3.2 新輔助放化免治療(nCRI)
雖然PD-1單抗在pMMR/MSS型直腸癌未顯示明確療效,但是與放療聯合進行新輔助治療顯示了良好的應用前景。
2023年ESMO報道的UNION研究[11]是全球首個評估短程放療(SCRT)序貫免疫治療聯合化療治療LARC的Ⅲ期臨床研究,納入231例T3/T4/N+的LARC患者,以短程放療聯合CAPOX、卡瑞利珠單抗對比nCRT的療效。nCRI組pCR率39.8%,nCRT組為15.3%(OR=3.7,P< 0.001,見圖2);兩組R0切除率均較高,分別為96.2% vs 97%,但nCRI組保肛率更高,為94.2% vs 89.9%,兩組≥3級治療相關不良反應發生率相似。顯示nCRI治療的療效優勢,且未增加安全性風險。
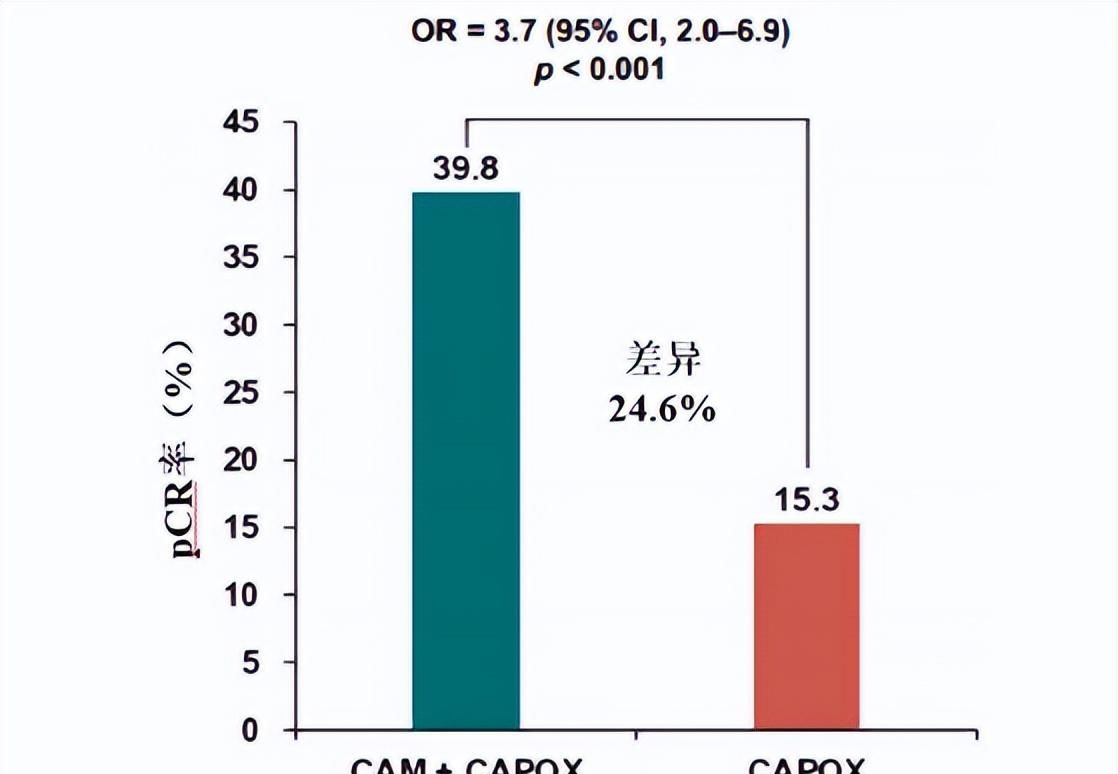
圖2. UINON研究ITT人群pCR率比較。(CAM:卡瑞利珠單抗)
TORCH研究[12]是特瑞普利單抗聯合TNT(短程放療)新輔助治療LARC的前瞻性、多中心Ⅱ期臨床研究,82.7%(86/104)的患者具有高危特徵:位置較低(5cm)、cT4、cN2、MRF+和EMVI+。A組鞏固治療組,短程放療後序貫XELOX+特瑞普利單抗6週期,後接手術;B組誘導治療組,XELOX+特瑞普利單抗2週期後短程放療,後續XELOX+特瑞普利單抗4週期,後接手術。29例患者達到cCR並採用W&W,59例患者治療後接受TME手術,其中29例達到pCR(49.2%,29/59),主要病理緩解率為62.7%(37/59)。主要研究終點CR率為55.8%(58/104),其中A組鞏固治療組為57.4% (31/54),B組誘導治療組為54.0%(27/50),顯示MSS直腸癌患者採取TNT聯合免疫治療可獲得良好臨床療效。
90%的直腸癌是MSS型,新輔助放化療可改善免疫微環境,聯用PD-1單抗可有效提升LARC的新輔助治療效果,nCRI有望成為高危復發MSS型LARC的標準治療,發現新的療效預測標誌物將對提高目標人群的精準治療提供指導。
邱健教授總結
新輔助治療對於區域性進展期直腸癌的治療具有重要臨床意義,一方面需要“減毒”,即精準選擇適應人群,選擇恰當治療方式,在保證療效的同時儘可能減少治療損傷;另一方面,對於區域性復發風險高、無法保肛的患者,需要“增效”,強化新輔助治療方案,提高pCR率,減少區域性復發,留存器官,儘可能帶來生存質量與時間雙獲益。新輔助放化療聯合免疫治療作為一種非常有前景的新輔助治療方案仍需要更多臨床研究,為最佳化全程新輔助治療各環節帶來優質循證醫學證據。
專家簡介:

邱 健 教授
陝西省人民醫院普外一科主任醫師、醫學博士
陝西省抗癌協會大腸癌專業委員會 主任委員
中華結直腸癌MDT聯盟陝西省分盟 主席
中國醫師協會結直腸腫瘤委員會微創解剖學組副組長
中國醫師協會外科醫師委員會結直腸外科專家工作組委員
中國醫師協會外科醫師委員會MDT專家工作組委員
中華醫學會腫瘤學分會結直腸腫瘤學組委員
中國抗癌協會中西醫整合結直腸癌專委會委員
中國抗癌協會結直腸癌整合康復專委會委員
參考文獻(向上滑動檢視):
[1] van Gijn W, Marijnen CA, Nagtegaal ID, et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol. 2011;12(6):575-582. doi:10.1016/S1470-2045(11)70097-3
[2] Sauer R, Liersch T, Merkel S, et al. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol. 2012;30(16):1926-1933. doi:10.1200/JCO.2011.40.1836
[3] Fernandez LM, São Julião GP, Figueiredo NL, et al. Conditional recurrence-free survival of clinical complete responders managed by watch and wait after neoadjuvant chemoradiotherapy for rectal cancer in the International Watch & Wait Database: a retrospective, international, multicentre registry study. Lancet Oncol. 2021;22(1):43-50. doi:10.1016/S1470-2045(20)30557-X
[4] Glynne-Jones R, Wyrwicz L, Tiret E, et al. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up [published correction appears in Ann Oncol. 2018 Oct 1;29(Suppl 4):iv263]. Ann Oncol. 2017;28(suppl_4):iv22-iv40. doi:10.1093/annonc/mdx224
[5] Schrag D, Shi Q, Weiser MR, et al. Preoperative Treatment of Locally Advanced Rectal Cancer. N Engl J Med. 2023;389(4):322-334. doi:10.1056/NEJMoa2303269
[6] Cercek A, Lumish M, Sinopoli J, et al. PD-1 Blockade in Mismatch Repair-Deficient, Locally Advanced Rectal Cancer. N Engl J Med. 2022;386(25):2363-2376. doi:10.1056/NEJMoa2201445
[7] Deng Y, Chi P, Lan P, et al. Neoadjuvant Modified FOLFOX6 With or Without Radiation Versus Fluorouracil Plus Radiation for Locally Advanced Rectal Cancer: Final Results of the Chinese FOWARC Trial. J Clin Oncol. 2019;37(34):3223-3233. doi:10.1200/JCO.18.02309
[8] Zhang Z, Sun X, Liu A, et al. A multicenter randomized phase III trial of capecitabine with or without irinotecan driven by UGT1A1 in neoadjuvant chemoradiation of locally advanced rectal cancer (CinClare). J Clin Oncol 2019; 37(15Suppl):3510
[9] Bahadoer RR, Dijkstra EA, van Etten B, et al. Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO): a randomised, open-label, phase 3 trial [published correction appears in Lancet Oncol. 2021 Feb;22(2):e42]. Lancet Oncol. 2021;22(1):29-42. doi:10.1016/S1470-2045(20)30555-6
[10] Conroy T, Bosset JF, Etienne PL, et al. Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol. 2021;22(5):702-715. doi:10.1016/S1470-2045(21)00079-6
[11] Zhang T, et al. Neoadjuvant short-course radiotherapy followed by camrelizumab plus chemotherapy versus long-course chemoradiotherapy followed by chemotherapy in locally advanced rectal cancer: A randomized phase III trial (UNION). 2023 ESMO Abstract LBA25
[12] Wang Y, et al. Short-course radiotherapy based total neoadjuvant therapy combined with PD-1 inhibitor for locally advanced rectal cancer: preliminary findings of TORCH. 2023 ESMO Abstract 601P
直腸癌是消化道常見惡性腫瘤之一,我國結直腸癌發病率和死亡率呈逐年上升趨勢。區域性進展期直腸癌(LARC)腫瘤體積大,易於侵犯其他臟器,淋巴引流較複雜,直接進行手術治療效果較差,系統治療顯得尤為重要。臨床試驗表明,新輔助治療可使直腸癌區域性癌腫縮小,降低區域性複發率,提高保肛可能性,已成為外科治療必不可少的技能,因此我們特邀陝西省人民醫院普外科邱健教授對LARC新輔助治療策略進行全面系統的解讀。
一、直腸癌的新輔助放化療
新輔助放化療(nCRT)是預防進展期直腸癌(LARC)術後區域性復發的重要治療手段,術前放療可使TME手術後10年區域性複發率降低50%,從11%降至5%[1];術前放化療優於術後放療,10年區域性複發率分別為7%與10%[2]。NCCN指南建議T3、T4或淋巴結陽性的區域性進展期直腸癌患者選擇新輔助放化療。
新輔助放化療可降期降級,有效降低了LARC的術後區域性復發,部分達到臨床完全緩解(cCR)的患者可採取觀察等待策略(Watch and Wait, W&W),患者持續cCR可避免外科手術,如果有腫瘤復發,可施行挽救性手術[3]。
但是,隨著新輔助放化療的推廣應用,其治療模式的不足也逐漸凸顯出來。第一種不足是放療帶來的放射性損傷。放療可增加患者發生吻合口漏(19.8%)、吻合口狹窄、腸道放射性腸炎、腸梗阻的機會。第二種不足是放療改變了手術治療流程,需要同期行預防性造口,再次手術還納造口。第三種不足是nCRT並未改善進展期直腸癌患者的長期生存。因此,針對LARC,“減毒”“增效”的新輔助治療成為業界探索的方向。
二、“減毒”的新輔助治療
2.1 篩選新輔助放化療獲益人群
2017年,歐洲腫瘤學會直腸癌臨床實踐指南應用高分辨核磁給予cT3精準分層,推薦cT3a/T3b區域性復發風險較小(5%)的一類患者直接給予高質量TME手術,避免術前放療。而對於T3c/T3d的直腸癌,N1-N2或存在壁外血管侵犯(EMVI+)需要接受新輔助放化療[4]。
2.2 直腸癌的新輔助化療(NAC)
2023年ASCO釋出來自北美的PROSPECT研究[5],納入T2N+、T3N0和T3N+的LARC患者1128例,研究NAC(選擇性放療)能否在這些患者取代nCRT。NAC(選擇性放療)給予6週期mFOLFOX6,評估腫瘤縮小20%以上者直接行TME手術,術後給予6週期mFOLFOX6輔助治療;退縮小於20%或未能完成術前化療者給予術前同步放化療。
中位隨訪58個月顯示:NAC組中,9.1%患者接受了術前放化療,1.4%患者接受術後放化療,89.5%的患者可豁免放療。NAC組的PFS非劣效於nCRT組(0.92,p=0.005,見圖1),NAC組pCR率21.9%,nCRT組pCR率為24.3%。5年PFS、OS均無明顯差異。NAC聯合選擇性放療策略已納入NCCN指南,作為T2N+、T3N0和T3N+ LARC的新輔助治療方式之一。PROSPECT研究顯示NAC與nCRT後5年區域性複發率均極低,分別為1.8%與1.6%,結合ESMO指南,對於復發風險較低的T3a/T3b患者可免於術前治療,而復發風險高的T3c/T3d/N+患者可採用NAC(選擇性放療)策略。

圖1. PROSPECT研究DFS的非劣性檢驗
2.3 新輔助免疫治療
錯配修復蛋白缺失(dMMR)/微衛星高度不不亂(MSI-H)是泛腫瘤PD-1單抗免疫治療有效性的預測標誌物。2022年, Cercek[6]報道dMMR/MSI-H的直腸癌12例,使用PD-1單抗Dostarlimab,每3週一次,連續使用6月,經MR、PET-CT、內鏡活檢、肛門指診證實直腸腫瘤完全消失,隨訪6~25月無復發徵象。儘管隨訪時間有限,但是該研究為直腸癌新輔助治療、免除手術、留存肛門及其功能提供了新的思路與方法。dMMR/MSI-H的 LARC新輔助免疫治療療效顯著,但是觀察時間仍然較短,對免疫治療使用時長、腫瘤區域性控制時間、是否能最終徹底免除手術等問題仍然需要觀察。
三、“增效”的新輔助治療
對於區域性高危復發風險的直腸癌,“增效”在於增加聯合治療強度,增強對放療的協同作用,增加新輔助放化療後病理完全緩解率(pCR)、減少區域性復發、留存器官、儘可能延長生存時間。比如我國的FOWARC研究[7]和CinClare研究[8],在單藥新輔助放化療基礎上,聯用奧沙利鉑或伊立替康後pCR分別達到27.5%和30%,但是仍未顯示增強化療後的生存獲益。
3.1全程新輔助放化療(TNT)
術後輔助化療因為患者耐受性下降,完成度不高可能影響生存獲益。將術後輔助化療全部提至手術前,序貫完成放療與全身化療,稱為全程新輔助放化療(TNT)。
RAPIDO研究[9]選擇區域性晚期直腸癌患者(T4/N2/EMVI+/MRF+/側方淋巴結+),研究組接受短程放療序貫CAPOX(FOLFOX4)再銜接手術,對照組為nCRT標準治療。兩組pCR率分別為28% vs 14%(OR 2.37,pp=0.019);3年遠處轉移率 20.0% vs 26.8%(HR 0.69, p=0.0048),提示TNT優於nCRT。而3年區域性復發 8.3% vs 6.0%(HR 1.42, p=0.12),提示原局控率已很高,在此基礎上難以獲得提升。3年OS 分別為89.1% vs 88.8%,(HR 0.92,p=0.5),並未顯示TNT帶來的生存優勢,可能需要延長觀察期限。
PEODIGE23研究[10]針對T3/T4 LARC,使用6週期FOLFIRINOX誘導化療後序貫CRT+手術+3月FOLFOX(CAPOX)輔助化療,對比CRT標準治療。兩組pCR率分別為28%與12%,3年區域性複發率分別為4%與6%(HR 0.78, p=0.56),3年DFS分別為76%與69% ( HR 0.69, p=0.034),3年無轉移生存率79% vs 72% (HR 0.64, p=0.017),3年OS顯示出了延長趨勢,為91% vs 88% (HR 0.65, p=0.0773), 提示強化新輔助化療可能透過減少全身轉移改善患者長期生存。
3.2 新輔助放化免治療(nCRI)
雖然PD-1單抗在pMMR/MSS型直腸癌未顯示明確療效,但是與放療聯合進行新輔助治療顯示了良好的應用前景。
2023年ESMO報道的UNION研究[11]是全球首個評估短程放療(SCRT)序貫免疫治療聯合化療治療LARC的Ⅲ期臨床研究,納入231例T3/T4/N+的LARC患者,以短程放療聯合CAPOX、卡瑞利珠單抗對比nCRT的療效。nCRI組pCR率39.8%,nCRT組為15.3%(OR=3.7,P< 0.001,見圖2);兩組R0切除率均較高,分別為96.2% vs 97%,但nCRI組保肛率更高,為94.2% vs 89.9%,兩組≥3級治療相關不良反應發生率相似。顯示nCRI治療的療效優勢,且未增加安全性風險。

直腸癌是消化道常見惡性腫瘤之一,我國結直腸癌發病率和死亡率呈逐年上升趨勢。區域性進展期直腸癌(LARC)腫瘤體積大,易於侵犯其他臟器,淋巴引流較複雜,直接進行手術治療效果較差,系統治療顯得尤為重要。臨床試驗表明,新輔助治療可使直腸癌區域性癌腫縮小,降低區域性複發率,提高保肛可能性,已成為外科治療必不可少的技能,因此我們特邀陝西省人民醫院普外科邱健教授對LARC新輔助治療策略進行全面系統的解讀。
一、直腸癌的新輔助放化療
新輔助放化療(nCRT)是預防進展期直腸癌(LARC)術後區域性復發的重要治療手段,術前放療可使TME手術後10年區域性複發率降低50%,從11%降至5%[1];術前放化療優於術後放療,10年區域性複發率分別為7%與10%[2]。NCCN指南建議T3、T4或淋巴結陽性的區域性進展期直腸癌患者選擇新輔助放化療。
新輔助放化療可降期降級,有效降低了LARC的術後區域性復發,部分達到臨床完全緩解(cCR)的患者可採取觀察等待策略(Watch and Wait, W&W),患者持續cCR可避免外科手術,如果有腫瘤復發,可施行挽救性手術[3]。
但是,隨著新輔助放化療的推廣應用,其治療模式的不足也逐漸凸顯出來。第一種不足是放療帶來的放射性損傷。放療可增加患者發生吻合口漏(19.8%)、吻合口狹窄、腸道放射性腸炎、腸梗阻的機會。第二種不足是放療改變了手術治療流程,需要同期行預防性造口,再次手術還納造口。第三種不足是nCRT並未改善進展期直腸癌患者的長期生存。因此,針對LARC,“減毒”“增效”的新輔助治療成為業界探索的方向。
二、“減毒”的新輔助治療
2.1 篩選新輔助放化療獲益人群
2017年,歐洲腫瘤學會直腸癌臨床實踐指南應用高分辨核磁給予cT3精準分層,推薦cT3a/T3b區域性復發風險較小(5%)的一類患者直接給予高質量TME手術,避免術前放療。而對於T3c/T3d的直腸癌,N1-N2或存在壁外血管侵犯(EMVI+)需要接受新輔助放化療[4]。
2.2 直腸癌的新輔助化療(NAC)
2023年ASCO釋出來自北美的PROSPECT研究[5],納入T2N+、T3N0和T3N+的LARC患者1128例,研究NAC(選擇性放療)能否在這些患者取代nCRT。NAC(選擇性放療)給予6週期mFOLFOX6,評估腫瘤縮小20%以上者直接行TME手術,術後給予6週期mFOLFOX6輔助治療;退縮小於20%或未能完成術前化療者給予術前同步放化療。
中位隨訪58個月顯示:NAC組中,9.1%患者接受了術前放化療,1.4%患者接受術後放化療,89.5%的患者可豁免放療。NAC組的PFS非劣效於nCRT組(0.92,p=0.005,見圖1),NAC組pCR率21.9%,nCRT組pCR率為24.3%。5年PFS、OS均無明顯差異。NAC聯合選擇性放療策略已納入NCCN指南,作為T2N+、T3N0和T3N+ LARC的新輔助治療方式之一。PROSPECT研究顯示NAC與nCRT後5年區域性複發率均極低,分別為1.8%與1.6%,結合ESMO指南,對於復發風險較低的T3a/T3b患者可免於術前治療,而復發風險高的T3c/T3d/N+患者可採用NAC(選擇性放療)策略。

圖1. PROSPECT研究DFS的非劣性檢驗
2.3 新輔助免疫治療
錯配修復蛋白缺失(dMMR)/微衛星高度不不亂(MSI-H)是泛腫瘤PD-1單抗免疫治療有效性的預測標誌物。2022年, Cercek[6]報道dMMR/MSI-H的直腸癌12例,使用PD-1單抗Dostarlimab,每3週一次,連續使用6月,經MR、PET-CT、內鏡活檢、肛門指診證實直腸腫瘤完全消失,隨訪6~25月無復發徵象。儘管隨訪時間有限,但是該研究為直腸癌新輔助治療、免除手術、留存肛門及其功能提供了新的思路與方法。dMMR/MSI-H的 LARC新輔助免疫治療療效顯著,但是觀察時間仍然較短,對免疫治療使用時長、腫瘤區域性控制時間、是否能最終徹底免除手術等問題仍然需要觀察。
三、“增效”的新輔助治療
對於區域性高危復發風險的直腸癌,“增效”在於增加聯合治療強度,增強對放療的協同作用,增加新輔助放化療後病理完全緩解率(pCR)、減少區域性復發、留存器官、儘可能延長生存時間。比如我國的FOWARC研究[7]和CinClare研究[8],在單藥新輔助放化療基礎上,聯用奧沙利鉑或伊立替康後pCR分別達到27.5%和30%,但是仍未顯示增強化療後的生存獲益。
3.1全程新輔助放化療(TNT)
術後輔助化療因為患者耐受性下降,完成度不高可能影響生存獲益。將術後輔助化療全部提至手術前,序貫完成放療與全身化療,稱為全程新輔助放化療(TNT)。
RAPIDO研究[9]選擇區域性晚期直腸癌患者(T4/N2/EMVI+/MRF+/側方淋巴結+),研究組接受短程放療序貫CAPOX(FOLFOX4)再銜接手術,對照組為nCRT標準治療。兩組pCR率分別為28% vs 14%(OR 2.37,pp=0.019);3年遠處轉移率 20.0% vs 26.8%(HR 0.69, p=0.0048),提示TNT優於nCRT。而3年區域性復發 8.3% vs 6.0%(HR 1.42, p=0.12),提示原局控率已很高,在此基礎上難以獲得提升。3年OS 分別為89.1% vs 88.8%,(HR 0.92,p=0.5),並未顯示TNT帶來的生存優勢,可能需要延長觀察期限。
PEODIGE23研究[10]針對T3/T4 LARC,使用6週期FOLFIRINOX誘導化療後序貫CRT+手術+3月FOLFOX(CAPOX)輔助化療,對比CRT標準治療。兩組pCR率分別為28%與12%,3年區域性複發率分別為4%與6%(HR 0.78, p=0.56),3年DFS分別為76%與69% ( HR 0.69, p=0.034),3年無轉移生存率79% vs 72% (HR 0.64, p=0.017),3年OS顯示出了延長趨勢,為91% vs 88% (HR 0.65, p=0.0773), 提示強化新輔助化療可能透過減少全身轉移改善患者長期生存。
3.2 新輔助放化免治療(nCRI)
雖然PD-1單抗在pMMR/MSS型直腸癌未顯示明確療效,但是與放療聯合進行新輔助治療顯示了良好的應用前景。
2023年ESMO報道的UNION研究[11]是全球首個評估短程放療(SCRT)序貫免疫治療聯合化療治療LARC的Ⅲ期臨床研究,納入231例T3/T4/N+的LARC患者,以短程放療聯合CAPOX、卡瑞利珠單抗對比nCRT的療效。nCRI組pCR率39.8%,nCRT組為15.3%(OR=3.7,P< 0.001,見圖2);兩組R0切除率均較高,分別為96.2% vs 97%,但nCRI組保肛率更高,為94.2% vs 89.9%,兩組≥3級治療相關不良反應發生率相似。顯示nCRI治療的療效優勢,且未增加安全性風險。

























